مقالات
بافت چربی
آماده سازی و پردازش نمونه های چرب
توضیح مختصر در مورد بافت چربی
در بافت شناسی، بافت چربی گونهای از بافت همبند شل است که بهطور عمده از آدیپوسیتها تشکیل میشود. این بافت ۸۰ درصد چربی را تشکیل میدهد و نقش اصلی آن ذخیره انرژی به صورت چربی است و موجب چاقی و اضافه وزن میگردد. دو نوع بافت چربی وجود دارد: بافت چربی سفید و بافت چربی قهوهای.
بافت چربی سفید چهار کار مهم را بر عهده دارد :
۱. عایق حرارتی
۲. ضربه گیر مکانیکی
۳. مهمترین منبع ذخیره انرژی بدن
۴. ترشح برخی هورمونها مانند لپتین، استروژن، آدیپونکتین، رزیستین، (PAI-1 ،اینترلوکین ۶ و عامل نکروز توموری آلفا )
بافت چربی قهوهای در اطراف گردن و عروق اصلی توراکس قرار دارد.
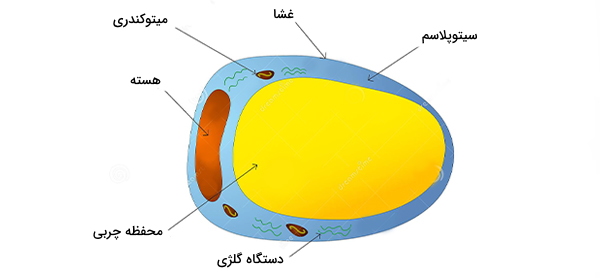
سلول چربی
سلول چربی (Adipocyte) که با اسامی انگلیسی «Lipocyte» و «Fat Cell» نیز شناخته میشود، جزء اصلی سازنده بافت چربی است که در ذخیره انرژی به صورت چربی تخصص دارد. سلولهای چربی از سلولهای بنیادی مزانشیمی (در دوران جنینی) مشتق شدهاند. در کشت سلولی، سلولهای چربی همچنین میتوانند استئوبلاست، میوسیت و انواع دیگر سلولها را تشکیل دهند. دو نوع سلول چربی وجود دارد که چربی سفید (WAT) و چربی قهوهای (BAT) را به وجود میآورند و سلولهای چربی بژ (نوع جدیدی که اخیراً کشف شده و در بافت چربی سفید پراکنده شدهاند) این نوع سلولها از نظر مورفولوژی و عملکرد متفاوت هستند. نوع سومی به نام چربی مغز استخوان نیز در بدن ویژگیهای خاص خود را دارد.
پردازش نمونه های چرب:
در طول این ارائه ، ما به بررسی راهکارهای آماده سازی نمونه های بافت چرب می پردازیم. در مرحله بعدی ، ما دلایل دشوار بودن، پردازش نمونه های چرب را تجزیه و تحلیل خواهیم کرد و همچنین می خواهیم در مورد روشهای مختلف بحث کنیم. همچنین در آخر ، تکنیک هایی برای پردازش بهتر و با کیفیت تر نمونه های چرب را شناسایی خواهیم کرد.
مرحله ی آغازین هیستولوژی جمع آوری نمونه می باشد. همانطور که می دانید اگر نمونه شما به درستی بدست نیاید ، نتایج مطلوبی را که می خواهید به دست نمی آورید. پس از اینکه نمونه را به درستی برداشتید حالا نوبت به مرحله ی فیکسایون یا تثبیت میرسد. برای مثال در مورد نمونه های بافت چربی ، نمونه ی پستان را در نظر بگیرید باید مقررات CAP را در مورد استفاده از فرمالین بافر خنثی یا NBF دنبال کنیم.
چرا پردازش نمونه های چرب کار ساده ای نیست؟
چرا پردازش نمونه های چرب بسیار دشوار است؟ همه اینها به دلیل ماهیت چربی است که اساسا کار نفوذ به سختی در آن صورت میگیرد.که بیشتر مواقع منجر به پردازش و آماده سازی کم و ناقص بافت میشود. در نهایت ، اغلب باعث می شود بافتی داشته باشیم که برش آن دشوار یا حتی غیرممکن است. بنابراین سوالی که برایمان پیش می آید این است، چه کاری می توانیم برای کمک به این روند انجام دهیم؟
grossing
از آنجایی که ما برای اینکار نیاز به شناخت نمونه و ماهیت آن داریم این کار از مرحله ی نمونه برداری آغاز می کنیم.نمونه هاییکه وارد فاز شناسایی می شوند ، دارای اطلاعات مناسب در مورد محل نمونه برداری و همچنین اطلاعات کافی در مورد بیمار هستند. پس از بررسی ها می توان فرایند جمع آوری grossing را آغاز کرد.
در مورد بافت چربی، انتخاب بهترین قطعه یا قطعات که بخوبی توانایی نمایندگی کل بافت را داشته باشد ضروریست. همانطور که پیش تر اشاره شد ، نفوذ در بافت چربی اساساً دشوار است ، بنابراین هنگام انتخاب قسمتی از بافت بعنوان نمونه، بایستی در نظر داشته باشید نمونه برای استفاده به پیرایش و اصلاح نیاز دارد. به این ترتیب که احتمالا نیاز به کوچک تر کردن نمونه خواهیم داشت.
در حالت مطلوب ، نمونه برداری 1 تا 2 میلی متری برای پردازش سریع و 3 تا 4 میلی متر برای پردازش معمول نیاز داریم. پس از انتخاب و اصلاح ، برای حفظ ویژگی های ظاهری از بافت بالقوه غیر طبیعی ، ممکن است به مرکب زنی ویژه حاشیه نیاز باشد. همچنین ، لازم به یادآوری است که به هیچ عنوان سعی نکنید بافت با سایز بزرگ تر را با فشار در داخل کاست جا کنید.
جمع آوری نمونه های چرب
در پردارش چربی ها انتخاب کاست نیز اهمیت دارد. هنگام انتخاب یک کاست ، اطمینان حاصل کنید که فضای کافی در آن کاست برای نفوذ مایعات در سراسر بافت وجود داشته باشد. اگر آن کاست کاملاً با بافت پر شود ، دیگر جایی برای نفوذ مناسب مایع وجود نخواهد داشت. پس باید اندازه ی کاست با توجه به اندازه ی نمونه انتخاب گردد.
نمونه بافت چربی
فیکساسیون بافت چربی
یکی از مهمترین مراحل در بافت شناسی، تثبیت یا همان فیکساسیون است ، خصوصاً در مورد بافت چربی. همانطور که می دانیم هدف از فیکساسیون و تثبیت ایجاد ماتریس پیوندهای عرضی برای بی حرکتی پروتئین های تشکیل دهنده بافت است. از آنجا که بدن ما از انواع پروتئین ها و لیپیدها ، کربوهیدرات ها و غیره تشکیل شده است ، ایجاد یک ماتریس از اتصالات عرضی فوق العاده مهم است. پس از انجام اینکار، از ادامه ی بیش از حد آن خودداری کنید چرا که ادامه ی بیشتر آن باعث تخریب بافت خواهد شد. متوقف کردن اتولیز(نابودی بافت ها توسط آنزیم های خود آنها ) باعث می شود بافت بر روی خود اثر نگذارد و همچنین پروتئین های داخل سلولی را از تجزیه شدن حفظ می کند. هدایت فرآیند تثبیت توسط یک عامل ثابت کننده انجام می شود.
ماده فیکساتیو
معیارهای مختلفی برای انتخاب ماده فیکساتیو (تثبیت کننده) وجود دارد که باید حتما هنگام انتخاب به آنها توجه شود. ابتدا می توان هنگام فیکساسیون از یک ماده فیکساتیو معمول استفاده کرد. اما در صورت نیاز به فیکساسون انواع سلولهای خاص از ترکیبات سلولی ، می توان از ماده های فیکساتیو ویژه ای برای حفظ این ساختارها استفاده کرد. به عنوان مثال ، فیکساتورهایی به نام fix-all وجود دارند که به طور خاص برای بافت متراکم توصیه می شوند ، همچنین باید در نظر داشت که فیکساتوری که انتخاب می کنید باید با مراحل بعدی، رنگ آمیزی سازگاری داشته باشند. (به عنوان مثال ، ایمونوهیستوشیمی در مقابل رنگ آمیزی معمول) در IHC ، هدف کاهش زمان استفاده از فرمالین است که می تواند به طور ناخواسته آنتی ژن را پوشانده و یا یک نتیجه منفی کاذب بالقوه ایجاد می کند.
برخی از خواص یک فیکساتور خوب چیست؟
یک ماده فیکساتیو مناسب ماده ای است که باید به سرعت در سلول ها نفوذ کند ، زیرا فیکساسیون از بیرون بافت آغاز میشود. وقتی به طور خاص در مورد نمونه های چرب صحبت می شود ، اغلب برش دادن آنها و اطمینان از داشتن چندین نقطه ورود به آن، باعث میشود تا لبه های میانی و خارجی بافت به یک میزان ثابت شوند. هنگام کار با بافت های چرب یا بافت های کشیده شده،برای اینکه اطمینان حاصل شود که ماده ثابت کننده می تواند به طور یکنواخت در بافت نفوذ کند، می توان از تکه های نازک چوب پنبه ، تعبیه شده در بافت چربی ، برای عدم تحرک بافت استفاده کرد. پنبه از پیچ خوردگی و فیکس ناهموار بافت جلوگیری می کند چرا که عدم فیکساسیون هموار بافت در باقی مراحل ما را با مشکل مواجه خواهد کرد.
.
مورد دیگری که باید به خاطر بسپاریم متغیرهایی هستند که می توانند بر فیکساسیون تأثیر بگذارند. ابتدا ماده فیکساتیو را انتخاب میکنیم. به عنوان مثال ، هنگامی که یک بطری NBF را باز می کنید ، شروع به اتصال عرضی ( crosslinking ) متقابل با خود می کند که این اتفاق میتواند نتایج بعدی را تحت تاثیر خود قرار دهد. مورد بعدی نسبت های حجمی است که اهمیت دارند. باید حداقل به نسبت 1.10 برابر بافت و در حالت ایده آل 1.20 برابر بافت، فیکساتور داشته باشیم .
ضخامت بافت نیز یک متغیر مهم است ، زیرا می تواند بر نفوذ به مرکز بافت تأثیر بگذارد. در حالت معمول ضخامت 4 میلی متر ایده آل است ، اما هنگام کار با نمونه های چرب ، هرچه بافت نازک تر باشد، بهتر است. در صورت امکان 2 میلی متر ضخامت مناسبی است. بسیاری از مواد شیمیایی در دسترس ما، در نفوذ لایه چربی مشکل دارند ، بنابراین هرچه نمونه ای که داریم نازک تر باشد ، بهتر است و مواد شیمیایی بهتر در آن بافت نفوذ خواهند کرد.
همچنین هنگام بررسی خصوصیات مطلوب فیکساتورها ، بر موارد زیر تمرکز کنید:
اولا ، ماده تثبیت کننده باید نتایج قابل تکرار و سازگار داشته باشد. میدانیم که هنگام فیکس کردن بافت ، بافت در داخل فرمالین تا 10٪ جمع شده و منقبض می شود ، اما آنچه مهمتر است این است که اتصالات عرضی بافت منجر به سخت شدن کافی برای حفظ اجزای سلولی می شود. بنابراین ، اگر پیوند عرضی موفقیت آمیز داشته باشیم ، بافت سفت می شود. که برای تقویت و تسهیل این فرایند ، فرمالین پروتئین ها را بهم پیوند می زند. پس از انجام عملیات فیکساسیون صحیح،عمل تجزیه بافت متوقف می شود. و در آخر مورد دیگری که در ویژگی های فیکساتیو مناسب می دانیم این است که، یک فیکساتیو مناسب باید آنزیم ها را غیرفعال کند ، باکتری ها و ویروس ها را از بین ببرد و خاصیت رنگ پذیری برای مراحل بعدی را تقویت کند.
فیکساسیون (تثبیت) بافت چرب
یکی از متداول ترین مواد فیکساتیو که برای فیکساسیون بافت های چرب نیز قابل استفاده میباشد ، فرمالین است. فرمالین محلول آبی فرمالدئید است. 10٪ فرمالین تقریباً 4٪ فرمالدئید دارد. فرمالین باید با pH 6.8 – 7.2 بافر شود و برای این کار نمک های بافر شده اضافه می شود. دلیل این اهمیت بسیار زیاد این است که در صورتیکه فرمالین بافر نشود ، یک رنگدانه را جا می گذارد. علاوه بر این ،برای به حداقل رساندن پلیمریزاسیون مولکول های فرمالدئید متانول نیز اضافه می شود. از آنجاییکه در مورد نمونه های چرب صحبت می کنیم ، جالب است بدانید که فرمالین یک ماده ثابت کننده لازم برای رنگ آمیزی HER2 / NEU است.
فرمالین الکلی
فیکساتیو رایج دیگری که برای پردازش بافت چربی استفاده می شود ، فرمالین الکلی است. این ماده می تواند به عنوان یک فیکساتیو ثانویه استفاده شود. یک ویژگی خوب در مورد فرمالین الکلی این است که ؛ نه تنها یک ماده فیکساتیو است بلکه فیکساتیوی است که با الکل مخلوط شده است بنابراین در حین عملیات فیکساسیون عمل آبگیری هم در جریان است.که به نمونه کمک می کند و به طور بالقوه در هنگام فیکساسیون نمونه های چرب تأثیر مثبتی در این روند خواهد داشت. فواید این ترکیب 50/50 الکل و فرمالین این است که الکل به آرامی در بافت نفوذ می کند و افزودن یک مرحله متوسط در فرمالین الکلی باعث می شود هنگامی که این بافت ظریف را در مرحله بعدی پردازش می کنید ، بافت اصطلاحا ” شوکه نشود “.

آبگیری Dehydration
پس از اتمام مرحله ی فیکساسیون (تثبیت) نوبت مرحله آبگیری است. برای آبگیری نمونه ها ، به طور معمول از مجموعه ای از درصد های افزایشی الکل استفاده میکنیم. الکل هایی که معمولاً در آبگیری بافت استفاده می شوند عبارتند از: اتانول ، متانول و الکل ایزو پروپیل. نکته مهم ، نوع الکل مورد استفاده در آبگیری نیز می تواند در رنگ آمیزی بافت در مراحل بعدی تأثیر گذار باشد. به عنوان مثال ، رنگ آمیزی هنگام استفاده از متانول با رنگ آمیزی ایزوپروپانول بسیار متفاوت خواهد بود. خصوصا که ، متانول باعث تولید هماتوکسیلین خاکستری و نتایج ائوزین کم رنگ تر خواهد شد. آبگیری ، آب به آرامی با الکل جایگزین می شود ولی همیشه باید با حجم کم حدودا 70% الکل شروع کنیم.
و این مورد اهمیت دارد چرا که اگر شما از محلولی بالاتر از 70٪ شروع کنید ، ممکن است باعث ایجاد نمک در تیشوپروسسور شود. در پایان این فرآیند ، در نتیجه ی فرایند ممکن است 3 تا 4 درصد آب در بافت باقی بماند که این آب پیوند خورده یا آب میان بافتی است که به ساختارهای سلولی بافت پیوند خورده است. آب پیوند خورده از اهمیت زیادی برخوردار است ، به ویژه هنگامی برش نمونه ها روی میکروتوم. در مورد انتخاب مواد برای مرحله آبگیری چند نمونه وجود دارد که در ادامه به آن می پردازیم:
اتانول
اولین گزینه اتانول است. اما هنگامی که برای فرایند استفاده میشود ممکن است اتانول برای اینکار بسیار گران باشد همچنین برای خرید و نگهداری آن نیاز به مجوز ویژه هست. با این حال ، گزینه های جایگزین متعددی وجود دارد. رایج ترین گزینه الکل با درجه مشخص است. این الکل از 90٪ اتانول ، 5٪ متانول و 5٪ ایزوپروپانول یا IPA تشکیل شده است. نکته مهم ، الکل های معرف به دلیل داشتن ماده متانول در دسته مواد کنترل شده طبقه بندی نمی شوند و بنابراین نیازی به ثبت پرونده برای نگهداری ندارند.
سرانجام ، ایزوپروپانول به خودی خود به ندرت به عنوان یک ماده آبگیری برای فرآیند با گزیلل استفاده می شود ، با این حال می تواند در فرآیند بدون گزیلل وبا مایکروویو استفاده شودو هنگامی که در پردازش سریع ، معمولی یا مایکروویو استفاده می شود ، نیاز ما به ماده پاک کننده را برطرف می کند. به طور موثر ، ایزوپروپانول می تواند در فرآیند بدون گزیلل جایگزین گزیلل باشد.
فرایند آبگیری بدون گزیلل (Dehydration/xylene-free )
استفاده از پروتکل بدون گزیلل با الکل ایزوپروپیل یا IPA در مورد روند آبگیری : برای پروتکل های بدون گزیلل شما احتمالاً دو مرحله مخلوط اتانول / ایزوپروپانول 20/80 و به دنبال آن سه مرحله ایزوپروپانول مطلق خواهید داشت. از آنجا که گزیلل یک حلال نسبتاً خطرناک است ، آزمایشگاه ها تحت فشار هستند تا به دنبال گزینه های کم خطر تر برای استفاده معمول باشند.
در این میان روشی بدون گزیلل ایجاد شده است که با این روش نیاز به گزیلل در فرایند حذف می شود که نه تنها به عنوان یک مرحله از پردازش است ، بلکه برای مراحل پارافین زدایی در طول رنگ آمیزی معمول نیز موثر است. در طی فرآیند ، شفاف سازی با گزیلل ، با مخلوط 80٪ اتانول و IPA جایگزین می شود. سرانجام ، می توان به برخی یا تمام مراحل، حرارت را اضافه کرد. در نظر گرفتن اندازه بافت مهم است ، زیرا بافت بزرگتر به مراتب حرارت بیشتری نیاز دارد.
شفاف سازی
اکنون به مرحله پاکسازی یا همان شفاف سازی رسیده ایم. شفاف سازی مرحله میانی بین آبگیری و نفوذ پارافین است و هدف آن از بین بردن الکل موجود در بافت است. هنگام انتخاب ماده شفاف سازی ، مهم است که ماده ای انتخاب شود که بافت را بیش از حد سفت و سخت نکند و بتواند هم با ماده آبگیری و هم با محیط آغشته سازی پارافین مخلوط شود.
ماده شفاف سازی مناسب
هنگام شفاف سازی بافت بهتر است در مورد انتخاب معرف ها دقت کنید. برای اینکار معمولا از گزیلل و جایگزین های آن استفاده می شود. ابتدا اجازه دهید در مورد گزیلل صحبت کنیم. گزیلل متداول ترین معرف برای شفاف سازی بافت است. به این دلیل که گزیلل معمولاً بافت کم آب را بخوبی تحت تاثیر قرار میدهد و همچنین خرید آن نیز ارزان است ، اما متاسفانه شرایط دور ریختن و دفع آن بسیار سخت و هزینه بر میباشد. بعلاوه ،گزیلل ماده ای بسیار اشتعال زا و خطرناک است.
همچنین قرار گرفتن طولانی مدت بافت در معرض آن باعث سختی و شکنندگی بافت شود. و سرانجام ، گزیلل با آب مخلوط نمی شود. به همین دلیل ، معمولاً جایگزین های آن برای پیاده سازی در مراحل آزمایشگاهی انتخاب می شوند. چرا؟ زیرا برای سلامتی اپراتور و بافت نمونه بهتر هستند و خطر کم تری دارند. به طور معمول ، ایمن تر و ملایم تر بوده و قابلیت اشتعال زایی کمتری نسبت به گزیلل دارند.علاوه بر این مزیت استفاده از آنها به جای گزیلل این است که در مقایسه با آن اغلب باعث سختی یا شکنندگی بافت نمی شوند.
نکته:
“Delimoning” مانند جایگزین های گزیلل بسیار چرب و ضخیم است و به همین دلیل ، برخی از تولید کنندگان استفاده از آنها را در آزمایشگاه توصیه نمی کنند.
نتیجه ی استفاده از جایگزین های گزیلل در کنار منافعی که دارد موانعی نیز دارد که یکی از آنها ، کاهش کارایی است ، زیرا برای کارکرد صحیح آنها باید آنها را بیشتر جابه جا کنید و بچرخانید و به جابه جایی بیشتری نیاز دارند.
آغشته سازی Infiltration
بعد از شفاف سازی مرحله آغشته سازی پارافین یا نفوذ است. پس از اتمام پردازش بافت ، پارافین وظیفه ی پشتیبانی و حمایت از بافت را دارد. انواع مختلفی از پارافین در بازار وجود دارد که هر کدام دارای نقطه ذوب متفاوتی هستند که عموماً از ترکیبات مختلف پلیمر حاصل می شود. در مرحله پردازش ، انتخاب پارافینی که برای پردازش بهینه است در مقابل پارافینی که برای قالبگیری بهینه است متفاوت است. پارافین های فرآوری شده به طور کلی حاوی پلیمرهای زیادی نیستند و ممکن است حاوی مواد افزودنی مانند DMSO باشند.
جالب اینجاست که وقتی DMSO به لوسیون های دست اضافه می شود ، زمان لازم برای نفوذ و خشک شدن لوسیون به پوست به میزان قابل توجهی کمتر از لوسیون های بدون DMSO است ، و این نشان دهنده اثربخشی آن است. همین امر هنگام پردازش بافت نیز صادق است.در مقابل ، پارافین های مناسب قالبگیری به طور کلی حاوی پلیمرهای زیادی هستند ، تا یک پشتیبانی و ماتریس بهتر برای برش و تقسیم فوق العاده نازک فراهم کنند.
بهترین روش: پردازش نمونه های چرب
بنابراین برای اینکه به چکیده ای از تمام این موارد برای پردازش چربی ها برسیم چند نکته و ترفند وجود دارد که بهتر است هنگام پردازش بافت چرب به آنها توجه کنیم:
- هنگام جمع آوری بافت چربی ، در صورت امکان ، باریک ترین بافت ممکن را بردارید.( ضخامت بافت 2 میلی متر را برای نفوذ بهتر ماده ی فیکساتیو در نظر بگیرید)
- در صورت امکان ، یک ماده فیکساتیو (تثبیت کننده) مطلوب و ایده آل حاوی الکل انتخاب کنید.
- در هنگام فیکساسیون ، بافت را روی چوب پنبه قرار دهید تا چین خوردگی به حداقل برسد و از قابلیت فیکساتور اطمینان حاصل شود.
- به طور متناوب ، بافت را نمره گذاری کنید تا فیکساتور به داخل بافت نفوذ کند.
- برای هدایت تبادل بهینه مایعات از کاست هایی با سوراخ های قطر بزرگتر استفاده کنید.
- نمونه های چرب بسیار ضخیم ممکن است به پروتکل طولانی تری نیاز داشته باشند.
- یک مرحله چربی زدایی به فرایند ها اضافه کنید. در یک مرحله چربی زدایی معمولاً از مخلوط 50/50 گزیلل و اتانول استفاده می شود. افزودن این مرحله در بین مراحل اتانول ها و گزیلل بسیار مهم است. همچنین باید اطمینان حاصل کنید که مراحل اتانول 100٪ پس از مرحله چربی زدایی و قبل از مراحل گزیلل انجام شده است.
- پارافین مناسب انتخاب کنید.(هنگام انتخاب پارافین بهینه ، به یاد داشته باشید که پارافین های مختلف در مراحل مختلف فرآیند مفید هستند. به عنوان مثال ، پردازش پارافین ها باید برای نفوذ و آغشته سازی بهینه باشد و شامل مواردی مانند DMSO باشد. با این حال ، پارافین های قالبگیری برای پشتیبانی و ایجاد ساختار محافظ بافت نیز باید بهینه باشند ، که اغلب حاوی مقادیر زیادی از پلیمر هستند).
نتیجه :
در این مقاله به بررسی روند کار با نمونه های چرب، پرداخته ایم. سپس دلایل دشوار بودن پردازش نمونه های چرب را مورد تجزیه و تحلیل قرار دادیم و در مورد فن آوری ها و معرف های مختلف برای پردازش بافت بحث کردیم. در آخر نیز تکنیک های با کیفیت خوب برای پردازش نمونه های چرب را شناسایی کردیم.
منابع
- https://www.leicabiosystems.com/knowledge-pathway/processing-fatty-specimens/
- 1-https://fa.wikipedia.org/wiki//بافت-چربی
- 2-http://daneshnameh.roshd.ir/mavara/mavara-index.php?page=%D8%A8%D8%A7%D9%81%D8%AA+%DA%86%D8%B1%D8%A8%DB%8C
- 3-https://blog.faradars.org//بافت-چربی-چیست



اشتراکها: آماده سازی بافت استخوان و دکلسفیکاسیون - دید سبز
اشتراکها: برش بافت - دید سبز برش بافت آموزش - آموزش برش بافت
اشتراکها: بازکردن بافت پس از برش - دید سبز - آموزش بازکردن بافت پس از برش
اشتراکها: سرطان - دید سبز - مقالات دید سبز - سرطان - دید سبز - مقالات